gas inerte
- 1. Kim.
- sin. gas noble
Helio, neon, argon, kripton, xenon eta radon elementuetako bakoitza. Atomo egonkorrak dira, eta kimikoki aktibotasun urria dute; salbuespen urrietan izan ezik, kimikoki geldoak edo inerteak dira. Beren konfigurazio elektronikoaren arabera, atomobakarrak dira edozein tenperaturatan.
Gaur egun, gas geldo gutxitan erabiltzen da kontzeptu hau adierazteko; izan ere, gas geldo, berez, beste substantzia batekin erreakzionatzen ez duen gasa da, eta, kondizio jakinetan, gas noble batzuek osa ditzakete konposatuak, helioa eta neona izan ezik.
- 2. Kim.
Kondizio normaletan beste substantziekin erreakzionatzen edo ia erreakzionatzen ez duen gasa.
- eu gas geldo, gas inerte
- en inert gas
- fr gaz inerte
- 1. Kim.
- Helio, neon, argon, kripton, xenon eta radon elementuetako bakoitza. Atomo egonkorrak dira, eta kimikoki aktibotasun urria dute; salbuespen urrietan izan ezik, kimikoki geldoak edo inerteak dira. Beren konfigurazio elektronikoaren arabera, atomobakarrak dira edozein tenperaturatan.
Gas nobleak Edit
Egilea: Maite Insausti
Helio, neon, argon, kripton, xenon eta radonari, hau da, 18. taldeko elementuei, gas noble deritze, haien egitura elektroniko egonkorraren ondorioz, ns2np6, erreakzionatzeko joera eskasa baita. 1962. urtera arte, inklusio-konposatuak eta ezegonkorrak ziren espezie batzuk ([HHe]+, [ArH]+…), baina ez ziren ezagunak. Alabaina, urte horretan, Xe-ezko konposatu batzuk sintetizatu ziren, hala nola XePtF6, XeF4 edo XeF2, eta frogatu zen gas “geldoak” ohi zirenak ez zirela guztiz geldo edo inerteak.
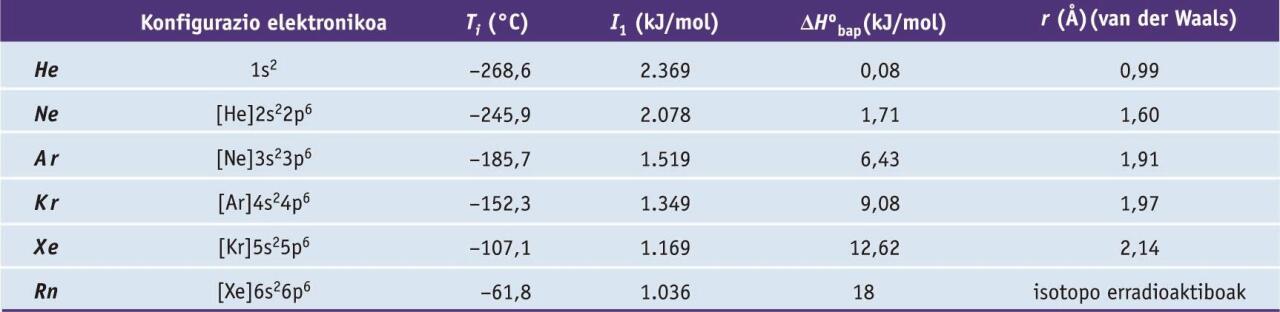
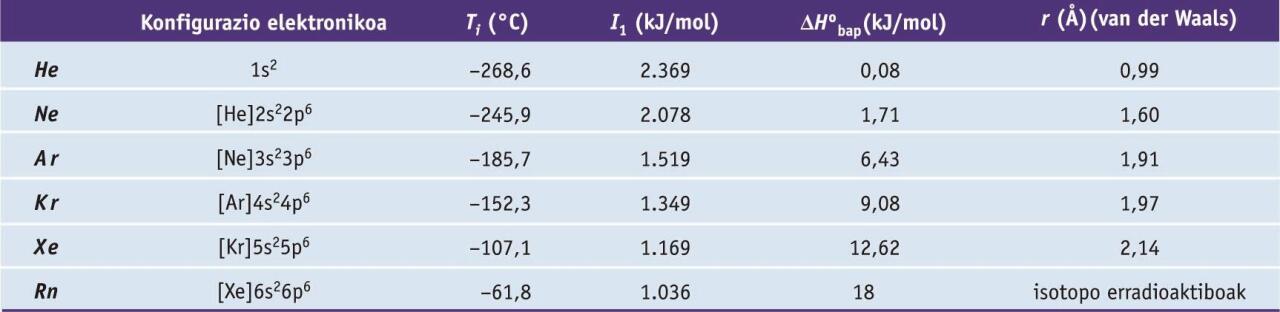
Gas nobleak kolorgeak, usaingabeak eta zaporegabeak dira, molekula monoatomikoz osaturik daude, eta oxidazio-egoera zero da. Atomoak esferikoak dira, eta izaera apolarra daukate. Ondorioz, molekulen arteko loturak van der Waals lotura ahulak dira, zeinen sendotasuna gas nobleen tamainarekin handiagotzen den. Gasen propietate fisiko nabarmenak hurrengo taulan azaltzen dira. Gas nobleen beste propietate orokor bat da laborategietan erabiltzen diren materialetan barreiatzeko duten gaitasuna.
Gas nobleen zenbait propietate fisiko
Atmosfera da gas nobleen iturri bakarra, helioaren kasuan izan ezik. Helioa Amerikako Estatu Batuetako gas naturalen biltegietan dago, non helio-edukia % 8ra bitartekoa izan daitekeen. Helioa lur azpian ere metatzen da, eta zenbait mineraletan aurkitu daiteke, lurrazaleko elementu erradioaktiboen partikulen igorpenaren ondorioz. Radona uranio eta torioaren eraldaketa erradioaktiboetatik sortzen da.
Helioa
Taula periodikoaren bigarren elementua da. Eguzkian gertatzen diren fusio nuklearretatik dator, eta bi isotopo egonkor azaltzen ditu: 4He (% 99,99987ko ugaritasuna) eta 3He (% 1,3.10-4). Polaritate oso txikia duenez, ezagun den irakite-tenperaturarik baxuena du, 4,2 K hain zuzen. Helioak oso propietate bereziak ditu. 2,18 K-ean (-puntua), 4HeI delakoa HeII bihurtzen da. HeII-aren bero espezifikoa 10 faktoreaz handitzen da, eroankortasun termikoa kobrearena baino 600 aldiz handiagoa da, eta biskositatea 0 inguruan dago. Hori dela eta, superfluido deritzo. HeII-ak gaitasuna dauka ehunka atomoz osaturiko geruzez helioari lotutako azalera solido guztiak estaltzeko. Helioa puxika eta baloi meteorologikoak puzteko erabiltzen da; horrez gain, erreaktore nuklearretan moderatzaile edo hozgarri modura; eta urpekariek, askotan, arnasteko botiletan O2/He nahastura eramaten dute, O2/N2 eraman beharrean, presio handietan N2-a odolean disolbatzean narkosia sortzen baitu. Helioa hozgarri modura erabiltzen da hainbat gailutan, bai medikuntzan, baita mekanika kuantikoaren eremuan ere; izan ere, horren bidez bakarrik lor daitezke zero absolutuaren inguruko tenperaturak.
Neona
Pisu arina duenez, gure atmosferatik astiro alde egiten ari da. Hiru isotopo egonkor ditu: 20Ne (% 90,51ko ugaritasuna), 22Ne (% 9,21ekoa) eta 21Ne (% 0,38koa). Gas noble honen erabilera nagusia neon-argia sortzea da. Ne-ak, potentzial-diferentziaren bidez kitzikatzean, kolore gorria duen eta oso distiratsua den argia igortzen du. Argiaren beste koloreak lortzeko, Ar, Kr eta Xe gasen proportzio jakin batzuekin nahasten dira.
Argona
Elementu honek atmosferaren ia % 1 osatzen du, eta airea likidotuz eta destilatuz eskuratzen da. Hiru isotopo egonkor ditu: 40Ar (% 99,60ko ugaritasuna), 36Ar (% 0,34koa) eta 38Ar (% 0,06koa). Saiakerak egin diren arren, oraindik ez da lortu argonezko konposaturik. Argonaren erabilera nagusia atmosfera geldoak sortzea da, hala behar duten industria-prozesu eta laborategi-erreakzioetarako.
Kriptona
Elementua urria izan arren, isotopo asko ditu. Konposatu batzuk eratzen ditu, adibidez: KrF2 kolorge eta lurrunkorra, zeina Kr-a eta F2-a −196 °C-an hoztuz eta deskarga elektrikoa aplikatuz sortzen baita. F–-arekin erreakzionatzean espezie kationikoak dituen konplexuak lor daitezke, hala nola [KrF]+[MF6]− edo [Kr2F3]+[MF6]− (M = As, Sb).
Xenona
Xenonaren berezitasuna da oxidazio-egoera desberdinetan konposatu egonkorrak eratzen dituela. Xe-ezko konposatuak RMN espektroskopiaren bidez azter daitezke, 129Xe-a erabiliz, zeinaren ugaritasun naturala % 26,4 den. Xe-a eta Kr-a laserretan eta argazkigintzako flash lanparetan erabiltzen dira.
Xenonaren konposatuak
Radona
Radonaren isotopo guztiak erradioaktiboak dira. Rn-aren erradiazioa gogorra da, eta gai da beira koloregabetu, konposatu gehienak deskonposatu eta ehun bizi guztiak suntsitzeko. Aplikazio nabarmenena da iturri erradiaktibo modura erabiltzea minbizi batzuen erradioterapia-tratamenduan eta zenbait metalen froga industrialetan.